"Los misterios y secretos de la vida, son una tarea difícil de explicar para el ser humano. Por ello, día con día nuevos descubrimientos le permiten encontrar piezas clave que son un reto dentro de su proceso de investigación o comprensión".
En el artículo anterior, nos referíamos a la importancia que tiene la formación de las acuaporinas. Por ello, conoceremos su conformación y mecanismos de regulación que hacen eficiente el manejo de los cultivos.
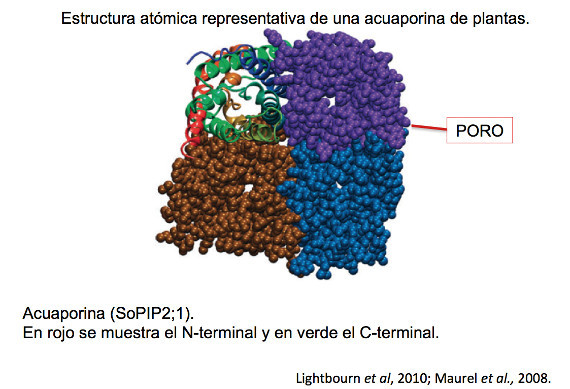
Las acuaporinas están ensambladas en las membranas que las contienen como homo-tetrámeros o hetero-tetrámeros, que constituyen un canal intracelular funcional. Cada uno constituido por seis dominios transmembranales con las terminaciones carboxilo y amino del lado del citoplasma. La mitad de las secuencias en la terminación mencionada, son similares. Estos dominios se unen por cinco lazos denominados A, B, C, D y E. Donde los B y D se localizan en la superficie interna de la membrana en dirección al citoplasma; mientras que los lazos A, C y E, están ubicados en la cara externa de la membrana.
Las acuaporinas se diferencian entre sí, por su secuencia de aminoácidos, que influye de manera directa en el tipo de moléculas nutrientes que pueden ser transportadas a través de ellas. En el poro central de la acuaporina se delimitan estos dominios y lazos hidrofóbicos (que rechazan el agua) B y E que contienen una región conservada de tres aminoácidos: Asparagina-Prolina-Alanina. A dicha región se le denomina “motif NPA”, porque son parte esencial en la estructura de las acuaporinas, determinan la permeabilidad selectiva del agua y definitivas para el anclaje de otro tipo de acuaporinas.
Una de las regiones vitales para la selectividad de las acuaporinas, se constituye por 4 residuos de aminoácidos, en los que se encuentran los residuos de aminoácidos aromáticos y un residuo de arginina denominado motif Ar/R. En él, el residuo de arginina tiene la función de ser un sitio electrostático de repulsión de protones, lo que hace a las acuaporinas impermeables de estos sustratos.
En PIPs, se determina que el residuo de histidina193 en el lazo D, es muy conservado, además actúa en el mecanismo de apertura y cierre de estas acuaporinas, provoca un cambio conformacional en el lazo D de la acuaporina favoreciendo el cierre del poro; mientras que en su apertura, el residuo His193 se encuentra desprotonado. Otras formas de aperturar el poro PIPs, es por medio de la fosforilación del residuo Ser 115 en el lazo B. El diámetro del poro que transporta otras moléculas como el glicerol, es mayor en tamaño, además contiene residuos de aminoácidos hidrofóbicos.
La expresión de ciertas acuaporinas es específica en diversos tipos de células y órganos vegetales, que se regulan por diversos factores ambientales como la energía lumínica. En el caso del nogal, la conductividad hidráulica de las hojas es baja durante la noche; sin embargo en el día incrementa hasta en un 400%. Además dependen de la expresión de la formación de acuaporinas PIP2;1 y PIP2,2 y no de manera directa a la apertura y cierre de los estomas. Por lo que, en diversos cultivos mantienen un ritmo circadiano, en el que a mayor temperatura, se agiliza su expresión.
Transporte de acuaporinas.
Recientes estudios indican que la localización intracelular de las acuaporinas es dirigida por un amplio rango de factores entre los que se encuentran las regiones conservadas y denominadas “motifs”, que son modificaciones postraduccionales, interacciones puentes de hidrogeno e interacciones proteína-proteína. Estas son insertadas en el retículo endoplasmático y sufren modificaciones a través de la ruta secretora.
En algunos experimentos se ha demostrado que PIP1 no es transportada a la membrana citoplasmática si no existe la presencia de PIP2, quedándose en el retículo endoplasmático. Lo que significa que PIP1, carece de un sistema de señalización para su transporte o inestabilidad sin la presencia de PIP2. Al realizar dichos experimentos, se reduce la conductividad hidráulica de las raíces entre un 36% a un 45%.
El sistema de señalización que tiene PIP2 para abandonar el retículo y continuar su ruta final, implica secuencias primarias conocidas como “motifs diacídicos”, las cuales contienen dos residuos de aminoácidos ácidos, separados por un residuo indeterminado, expresándose como la secuencia DXE (ácido aspártico-X-ácido glutámico), o bien EXD (ácido glutámico-X- ácido aspártico). Estas secuencias sirven como señal para COPII, que transporta hacia el retículo endoplasmático al aparato de Golgi. Posteriormente su traslado anterógrado de las acuaporinas PIP, necesita que contengan en su sección transmembranal 3, residuos de leucina en la posición 127 y alanina en la posición 131, lo cual es representado como la región LXXXA.
La fosforilación de las PIP2, también incluyen el transporte desde el retículo hasta la membrana. Con lo que se comprueba que en el residuo de serina 283 es necesaria para realizar el transporte de las acuaporinas PIP2, mientras que la fosforilación en el residuo 280 no tiene efecto.
Otro mecanismo de regulación de las acuaporinas PIPs, es su interacción con otros factores proteicos SNAREs (soluble N-ethylmaleimide-sensitive factor protein atachment protein receptor, por sus siglas en inglés), los cuales como familia proteica, regulan la fusión de vesículas en el sistema endomembranal. Además, están ligadas tanto a la vesícula transportadora, como a la membrana que dirige a la vesícula. Ambas interactúan formando una estructura hidrofóbica y logran la fusión de ambas membranas.
Se ha observado que el bloqueo de la acción de proteínas SNAREs, como SYP121, reduce la cantidad de ZmPIP2;5, además de una interacción directa entre ambas representada como SYP121-PIP2 para el anclaje de PIP2 en la membrana citoplasmática.
Otras proteínas SNAREs identificadas en la participación es la SYP61, han demostrado su interacción con acuaporina PIP2 y la formación de complejos con SYP121. Aparentemente estas se encuentran en la membrana citoplasmática, mientras que la proteína SYP61, se localiza en endosomas. Por ello se sugiere que un segundo mecanismo de transporte en lugar de interactuar con las proteínas SYP121 únicamente. Se lleva a cabo una interacción SYP61 desde la vesícula con SYP121 de la membrana citoplasmática para crear la fusión de las membranas y con ello el anclaje de las acuaporinas PIP2.
Las PIPs, también tienen un mecanismo de movilidad lateral, que significa que las acuaporinas con mayor longitud de sus lazos de la cara externa de la membrana citoplasmática, obtendrá mayor restricción en su movimiento. En condiciones idóneas, manifiestan una constante recirculación. Lo que aún no se ha descubierto es la razón por la que este proceso existe, probablemente sea un mecanismo de reparación, que durante una exposición a estrés por una aplicación excesiva de fertilizantes salinos, este es incrementado.
En el caso de la acuaporinas TIPs, se han detectado dos mecanismos de transporte: 1) en el primer mecanismo, la proteína sigue su proceso postraduccional a través del retículo endoplásmico y posteriormente pasa al aparato de Golgi para dirigirse a la vacuola. 2) En este mecanismo, el transporte es independiente del paso por el aparato de Golgi, esto significa que algunas acuaporinas TIP, pasan directamente del retículo endoplasmático a la vacuola.
La eficiencia de alta productividad agrológica requiere que el productor, como los técnicos asesores agrológicos, cuenten con información sobre los mecanismos internos celulares de las plantas, ya que una decisión inadecuada al momento de nutrir un cultivo o un cambio climático inesperado, incide sobre los procesos de traducción y señalización al interior de estas. Al conocer este funcionamiento, les permite adelantarse a posibles escenarios de riesgo, lograr los objetivos productivos y económicos programados.





















